Confianza para pacientes y profesionales de la salud
Medidas para la salud, seguridad y farmacovigilancia
Con carácter general y en el marco de la Política de calidad de Grifols, la compañía identifica los atributos críticos de sus productos, realizando exhaustivos controles que abarcan la calidad de las materias primas, controles a lo largo de los procesos productivos y pruebas de producto final.
Grifols dispone de acuerdos de farmacovigilancia con todos los distribuidores, incluyendo aquellos que distribuyen en países con normativas de farmacovigilancia poco avanzadas, para asegurar que se cumplen los estándares de Grifols en esta materia.
Además, dispone de un sistema de farmacovigilancia para el control de reacciones y efectos adversos que puedan derivarse de la administración de medicamentos y de un sistema de vigilancia para el control de reacciones adversas derivadas del uso de los productos sanitarios y productos sanitarios in vitro (medical devices e in vitro medical devices). De acuerdo con ambos programas, la compañía cuenta con un sistema de notificación de sospechas de reacciones y efectos adversos e incidentes de seguridad.
Todas las actividades y requisitos del sistema de farmacovigilancia y del sistema de vigilancia de productos sanitarios y productos sanitarios in vitro están descritos en los procedimientos estándar de trabajo de Grifols y son actualizados periódicamente. Grifols también realiza regularmente auditorías internas de ambos sistemas en el marco de cumplimiento establecido en sus sistemas de calidad. Ambos sistemas también se someten a inspecciones externas por parte de las autoridades sanitarias competentes.
Grifols no subcontrata a terceras compañías para las principales actividades de farmacovigilancia o vigilancia de productos sanitarios y productos sanitarios in vitro.
Estuches, prospectos y etiquetado
La información contenida en los los estuches, prospectos y etiquetas de los medicamentos está establecida de acuerdo con los estándares y regulación aplicable en cada país donde los productos de Grifols son comercializados, incluyendo las Normas de Correcta fabricación de medicamentos.
En el caso de los productos sanitarios y productos sanitarios in vitro, el etiquetado, las instrucciones de uso de los reactivos y los manuales de usuario y de softwares de los instrumentos cumplen las regulaciones específicas de cada país (EN ISO 15223, entre otras) e incluyen cualquier medida mitigadora identificada en base a la gestión de riesgos de productos sanitarios (EN ISO 14971 Medical Devices) o conforme a los requerimientos de las autoridades sanitarias. Todos los materiales impresos son traducidos a los idiomas correspondientes, son actualizados a medida que se requieren y accesibles para los usuarios.
Sistema de retirada de productos del mercado
El sistema de retirada de producto del mercado se rige por la política corporativa de seguridad de los pacientes y los clientes.
Asimismo, este sistema se desarrolla en los procedimientos estandarizados de trabajo y es auditado internamente por la compañía para verificar su efectividad y su adaptación a las normas vigentes. También es inspeccionado por las autoridades sanitarias competentes.
Todos los equipos de Grifols involucrados en posibles retiradas de producto del mercado, ya sean voluntarias u obligatorias, son formados específicamente en la adecuada gestión de posibles incidentes. Además, Grifols realiza periódicamente simulaciones de retiradas de producto para asegurar que todos los procedimientos y protocolos de gestión de crisis funcionan, así como para identificar cualquier potencial aspecto de mejora.
El sistema de retirada de producto incluye procedimientos para informar a las autoridades sanitarias, asociaciones de pacientes y profesionales de la salud sobre los riesgos potenciales del producto retirado. La compañía dispone de un centro de atención telefónica y determinados productos disponen de web propia donde se publica la información para dar difusión sobre los riesgos potenciales. Asimismo, la compañía prohíbe la utilización de un producto retirado del mercado en ensayos clínicos.
Durante 2023, en Grifols no se ha producido ninguna retirada obligatoria de producto por motivos de calidad o seguridad de sus productos. Grifols y Biotest han procedido a la retirada voluntaria de 2 lotes de producto. Los férreos controles de Grifols garantizan el cumplimento de los estándares de calidad y seguridad de manera integral.
Sistema de reclamaciones
Grifols dispone de un sistema de reclamaciones, descrito en una política corporativa, mediante el cual se registran y evalúan todas aquellas notificaciones recibidas por parte del personal de Grifols, de los centros sanitarios, pacientes o usuarios relativos a apreciaciones por parte de los consumidores de posibles defectos de la calidad de los productos. La gestión de las actividades del servicio técnico de productos sanitarios está conectada con servicio de gestión de reclamaciones, de manera que cualquier servicio técnico solicitado por un cliente es valorado.
En el momento en el que una filial o un centro de atención telefónica autorizado recibe una reclamación relacionada con un producto o servicio comercializado por Grifols, lo notifica de manera oportuna a la planta responsable del producto. De este modo se asegura que todas las reclamaciones recibidas se evalúan apropiadamente siguiendo el sistema de reclamaciones establecido.
El área de calidad de cada unidad de negocio es responsable de evaluar las reclamaciones recibidas, realizar las investigaciones pertinentes, asegurar que se implementan acciones correctivas y preventivas si procede, notificar a las autoridades sanitarias si procede y dar respuesta al cliente con las conclusiones obtenidas en la investigación de la reclamación.
 RATIO DE RECLAMACIONES RECIBIDAS POR UNIDADES DE NEGOCIO
RATIO DE RECLAMACIONES RECIBIDAS POR UNIDADES DE NEGOCIO
Biopharma
1 por cada 97.895
unidades distribuidas
2022: 1 por cada 77.806
unidades distribuidas
Diagnostic
1 por cada 559.298
test diagnósticos
2022: 1 por cada 482.302
test diagnósticos
Bio Supplies
1 por cada 2.777
unidades distribuidas
2022: Bio Supplies no recibió
ninguna reclamación
1 por cada 14.972.662
unidades distribuidas
2022: 1 por cada 5.848.478
unidades distribuidas
Otros (Productos sanitarios)
1 por cada 50.005
unidades distribuidas
2022: 1 por cada 31.210
unidades distribuidas
1 por cada 26.111
unidades distribuidas
2022: 1 por cada 32.532
unidades distribuidas
Sistema de prevención de medicamentos falsificados
Los medicamentos falsificados suponen un grave riesgo para la salud. Los medicamentos plasmáticos son de prescripción médica y principalmente de uso hospitalario.
Grifols colabora con las autoridades regulatorias en las investigaciones y análisis de producto sospechoso de ser falsificado. Grifols dispone de una Política interna de prevención, detección y comunicación de falsificaciones. Según esta política, las sospechas de falsificación de medicamentos y la confirmación de detección de productos falsificados deben ser notificadas a las autoridades regulatorias correspondientes en tiempo y forma de acuerdo con la normativa vigente aplicable.
En el marco de su total compromiso con las autoridades regulatorias para prevenir las falsificaciones, Grifols cumple con los requisitos de serialización y agregación de productos mediante la tecnología Track&Trace como exigen varios países y regiones. Además de las medidas obligatorias, se utilizan medidas adicionales contra la falsificación, como la identificación de los viales con un código único antes de comercializar cualquier producto plasmático y la inclusión en los envases de un sello holográfico para asegurar su inviolabilidad y autenticidad.
Grifols se somete regularmente a auditorías internas e inspecciones para garantizar el cumplimiento de las regulaciones y realiza la debida diligencia con los clientes y distribuidores para verificar que tienen las licencias necesarias para distribuir los productos. Asimismo, detalla las medidas a tomar en caso de sospecha de falsificación en sus contratos y acuerdos de calidad con terceros cuando aplica.
Desde 2021, Grifols no tiene conocimiento de ninguna acción que haya dado lugar a redadas, incautaciones, detenciones y/o presentación de cargos penales relacionados con productos falsificados.
Para más detalle consultar la Política anti-falsificaciones
Marketing responsable
La compañía se asegura de que todos los materiales promocionales o educativos que desarrolla cumplen con las leyes y reglamentos vigentes; son coherentes con las políticas y códigos de la industria adoptados voluntariamente por la organización; se adecuan a la audiencia y usuarios finales; y toda la información que contienen es veraz, fidedigna, completa y equilibrada.
Grifols dispone de un procedimiento operativo estándar que define las actividades y responsabilidades relacionadas con la aprobación, revisión y control de los materiales con fines promocionales y educativos de uso externo relativos a productos y servicios de la compañía. Es el denominado Grifols Review Process (GRP, por sus siglas en inglés). Representantes de los departamentos de Legal, Medical y Regulatory Affairs revisan y aprueban los materiales mediante una herramienta electrónica adaptada al proceso GRP. Cada material y contenido son aprobados, específicamente, para un uso y países concretos y sólo puede ser utilizado sin alteraciones. Por ello, todo el material promocional o educativo es revisado regularmente para asegurar que su contenido se adecúe a las normas vigentes y códigos adoptados y continúe siendo válido.
Se imparte formación adecuada sobre prácticas de ventas y marketing responsable de conformidad con el Código de conducta y la Política anticorrupción.
De las actividades del año 2023, únicamente se ha recibido 1 reclamación sobre marketing atendida de acuerdo a los procedimientos establecidos. La reclamación no ha derivado en impacto monetario alguno.
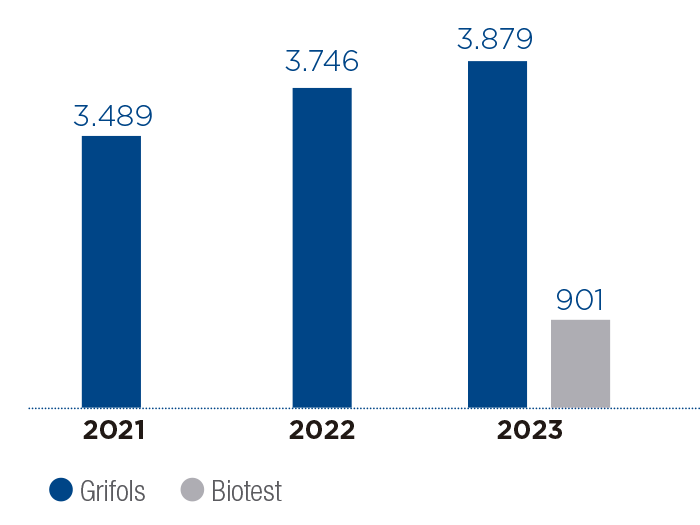
Materiales revisados
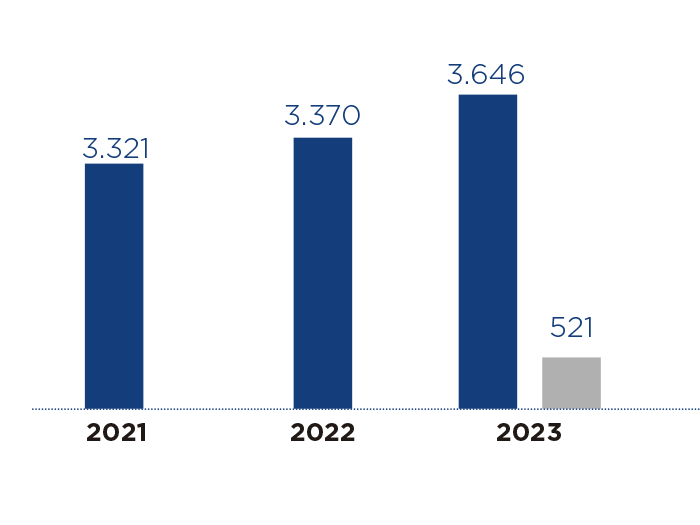
Materiales aprobados
Evolución total número de auditorías e inspecciones
PLASMA PROCUREMENT
Auditorías internas
256 (Grifols)
14 (Biotest)
Inspecciones de autoridades sanitarias y organismos de inspección acreditados
529 (Grifols)
9 (Biotest)
Auditorías a proveedores favorables
57 (Grifols)
4 (Biotest)
BIOPHARMA***
Auditorías internas
53 (Grifols)
20 (Biotest)
Inspecciones de autoridades sanitarias y organismos de inspección acreditados
22 (Grifols)
8 (Biotest)
Auditorías a proveedores favorables
139 (Grifols)
36 (Biotest)
DIAGNOSTIC
Auditorías internas
52
Inspecciones rutinarias por parte de organismos oficiales
14
Auditorías a proveedores favorables
28
OTROS****
Auditorías internas
76
Inspecciones rutinarias por parte de organismos oficiales
27
Auditorías a proveedores favorables
70
Incidentes relacionados con la suspensión, revocación o pérdida de cualquier licencia o certificación; carta de advertencia, suspensión impuesta de cualquier actividad regulada**
0
BIO SUPPLIES
Auditorías internas
2
Inspecciones rutinarias por parte de organismos oficiales
6
BUENAS PRÁCTICAS DE FABRICACIÓN

*Incluye número de inspecciones de autoridades sanitarias y organismos de inspección acreditados, así como el número de inspecciones internas
**Incluye Grifols y Biotest
***Antigua División Bioscience
****Otros: incluye antigua División Hospital